
ĐĂNG KÝ THÀNH CÔNG
Bộ phận CSKH sẽ phản hồi bạn trong thời gian sớm nhất
Số 9, đường Trần Bình, phường Từ Liêm, TP Hà Nội
Bài dịch:
NHIỄM SARS-COV-2 VÀ HÚT THUỐC:
MỐI LIÊN QUAN LÀ GÌ? ĐÁNH GIÁ TÓM TẮT
Ishita Gupta,a,b Muhammad Umar Sohail,c Khaled E. Elzawawi,a Ahmed H. Amarah,a Semir Vranic,a,b Maha Al-Asmakh,b,d,e and Ala-Eddin Al Moustafaa,b,e
a College of Medicine, QU Health, Qatar University, Doha, Qatar
b Biomedical and Pharmaceutical Research Unit, QU Health, Qatar University, Doha, Qatar
c Proteomics Core, Weill Cornell Medicine, Qatar Foundation-Education City, P.O. Box 24144, Doha, Qatar
d Department of Biomedical Sciences, College of Health Sciences, QU Health Iniversity, Doha, Qatar
e Biomedical Research Center, QU Health, Qatar University, Doha, Qatar
Computational and Structural Biotechnology Journal
(Tạp chí công nghệ sinh học và khoa học máy tính-Hà Lan)
Publisher: Elsevier , Radarweg 29, Amsterdam, Netherlands, 1043 NX.
ISSN / eISSN: 2001-0370
Website: https://www.elsevier.com
Người dịch: TS. BS. Trần Trọng Dương
Khoa Kiểm soát nhiễm khuẩn, Bệnh viện 19-8
|
Lịch sử bài báo: Nhận bài: 14/12/2020 Nhận chỉnh sửa: từ 12/3/2021 Được chấp nhận: 20/3/2021 Đăng tải: 23/3/2021 (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7985684/) |
TÓM TẮT
Khả năng bị bệnh nặng do COVID-19 được cho là có liên quan đến việc hút thuốc lá vì nó làm trầm trọng thêm nguy cơ mắc bệnh tim mạch và hô hấp, bao gồm cả nhiễm trùng. Điều này đặc biệt quan trọng với sự ra đời của một dòng coronavirus mới, coronavirus gây hội chứng hô hấp cấp tính nghiêm trọng (SARS-CoV-2) đã dẫn đến đại dịch hiện nay, bệnh coronavirus 2019 (COVID-19). Mặc dù, tác động của hút thuốc đối với COVID-19 ít được mô tả và gây tranh cãi, chúng tôi cho rằng có mối liên hệ giữa hút thuốc và COVID-19. Hút thuốc đã được chứng minh là làm tăng cường sự biểu hiện của sự chuyển đổi enzym angiotensin-2 (ACE-2) và transmembarane serine protease 2 (TMPRSS2) xuyên màng được sử dụng bởi SARS-CoV-2 để lây nhiễm các tế bào và gây ra 'cơn bão cytokine', làm tăng thêm mức độ nghiêm trọng của diễn biến lâm sàng COVID-19. Tuy nhiên, tác động của hút thuốc đối với sự biểu hiện của thụ thể ACE-2 và TMPRSS2 vẫn là một nghịch lý. Do đó, cần nghiên cứu thêm để làm sáng tỏ mối liên quan giữa hút thuốc lá và COVID-19 và theo đuổi sự phát triển của các liệu pháp mới tiềm năng có thể hạn chế tỷ lệ mắc bệnh và tử vong do căn bệnh truyền nhiễm này gây ra. Sau đây, chúng tôi trình bày tổng quan ngắn gọn về kiến thức hiện tại về mối tương quan giữa hút thuốc và sự biểu hiện của các gen xâm nhập chính của SARS-CoV-2, các biểu hiện lâm sàng và sự tiến triển của bệnh.
Từ khóa: SARS-CoV-2, Coronavirus, COVID-19, Smoking, Lung disease, Oral disease
1. ĐẶT VẤN ĐỀ
Sự bùng phát hiện tại của hội chứng hô hấp cấp tính nghiêm trọng mới do coronavirus 2 (SARS-CoV-2) gây ra, gây ra một bệnh hô hấp nghiêm trọng được gọi là bệnh coronavirus 2019 (COVID-19). SARS-CoV-2 là một loại vi rút RNA có vỏ bọc có khả năng lây lan từ động vật sang người cao. Phân tích di truyền cho thấy SARS-CoV-2 thuộc giống Betacoronavirus và chi Sarbecovirus, cho thấy rằng coronavirus có nguồn gốc từ loài dơi (BatCoV RaTG13) [1]. Vụ dịch ban đầu, bắt đầu ở Vũ Hán, Trung Quốc, tiếp tục lây nhiễm các chuỗi thứ cấp thông qua du lịch quốc tế và lan truyền đến hơn 180 quốc gia và vùng lãnh thổ [2]. Tính đến tháng 10 năm 2020, hơn 34 triệu trường hợp được xác nhận đã được báo cáo, bao gồm hơn một triệu trường hợp tử vong, với số lượng gia tăng các trường hợp được báo cáo ở Ấn Độ, Hoa Kỳ và Brazil [3]. SARS-CoV-2 là một bệnh siêu lây nhiễm với sự lây truyền giữa các cá nhân qua bình xịt và bọt khí; vi rút vẫn hoạt động với môi trường trong khí quyển và trên các bề mặt trong vài ngày [4]. Những đặc điểm này khiến virus có khả năng lây lan nhanh chóng và gây ra đại dịch toàn cầu.
Sự bùng phát ban đầu được trình bày dưới dạng viêm phổi chưa rõ nguyên nhân. Khi dịch phát triển thành đại dịch toàn cầu, rõ ràng là nhiễm trùng SARS-CoV-2 góp phần gây ra bệnh đa cơ quan, với tỷ lệ cao hội chứng suy hô hấp cấp (ARDS) và các biến chứng đường tiêu hóa [5]. SARS-CoV-2 có nhiều biểu hiện lâm sàng từ không triệu chứng đến rối loạn chức năng nhiều cơ quan [6]. Bệnh được phân loại thành nhẹ, trung bình, nặng và nguy kịch, tùy thuộc vào mức độ nghiêm trọng của biểu hiện, trong khi các triệu chứng phổ biến nhất bao gồm sốt, ho, tiêu chảy và mệt mỏi [6]. Dựa trên các giá trị R-naught (R0), người ta coi SARS-CoV-2 dễ lây lan hơn các đại dịch coronavirus trước đây (SARS hoặc MERS) [7], [8]. Một số phân đoạn dân số nhất định có nguy cơ tử vong cao hơn, bao gồm người cao tuổi, suy giảm miễn dịch, bệnh nhân mắc bệnh đi kèm và người hút thuốc [9], [10]. Nhìn chung, những người hút thuốc lá dễ mắc các bệnh về đường hô hấp hơn những người không hút thuốc [11]. Những người hút thuốc lá cũng có nguy cơ mắc bệnh cúm, bệnh lao và viêm phổi do vi khuẩn cao gấp đôi [12], [13]. Một phân tích tổng hợp cho thấy 22% (n = 31/139) người hút thuốc hiện tại và 46% (n = 13/28) người hút thuốc cũ bị biến chứng nặng, bao gồm ARDS [14]. Tuy nhiên, phân tích nguy cơ tương đối (RR) cho thấy những người hút thuốc hiện tại có nguy cơ bị các biến chứng nặng gấp 1,45 lần so với những bệnh nhân trước đây và chưa từng hút thuốc [14], [15], [16]. Tuy nhiên, vai trò của hút thuốc đối với COVID-19 vẫn còn nhiều tranh cãi [14], [17], [18]. Tổng quan này sẽ tập trung vào mối quan hệ giữa hút thuốc lá và các thụ thể của SARS-CoV-2 và tác động lên COVID-19 dẫn đến tổn thương mô và các bệnh đặc biệt là ở phổi.
2. SARS-CoV-2 VÀ CÁC GEN XÂM NHẬP
Từ “corona” trong tiếng Latinh có nghĩa là hình dáng giống như chiếc vương miện của các hình ảnh cấu trúc coronavirus. Các glycoprotein tăng đột biến xuyên màng loại 1 lớn (S) là thuộc tính cho hình dạng vầng hào quang của virus. S glycoprotein bao gồm hai miền chức năng riêng biệt (S1 và S2) được giả định là trung gian cho sự liên kết tế bào chủ, sự dung hợp màng và sự xâm nhập của virus [19]. Khu vực S1 chứa các vị trí liên kết thụ thể đối với enzym angiotensin-2 (ACE2) và chịu trách nhiệm cho sự xâm nhập của virus vào tế bào chủ [20]. Khu vực S2 cho phép hợp nhất màng vi rút và tế bào chủ, rất cần thiết cho sự xâm nhập của tế bào [21].
Vẫn còn hạn chế về hiểu biết về các con đường gây bệnh của SARS-CoV-2. Các virus xâm nhập vào tế bào biểu mô đường hô hấp của vật chủ thông qua nhận dạng tế bào metallopeptidase. Các enzym của tế bào chủ phải phân cắt glycoprotein S ở hai vị trí khác nhau để coronavirus đi vào tế bào đích, do đó tạo ra các mục tiêu thuốc tiềm năng. Một số enzyme chủ được biết là có khả năng hoạt hóa SARS-CoV-2, bao gồm cathepsin L, furin, và TMPRSS2, TMPRSS4, TMPRSS11A và TMPRSS11D [22]. Tuy nhiên, TMPRSS2 và furin đóng vai trò quan trọng trong quá trình hoạt hóa phân giải protein của SARS-CoV-2 [23]. Furin và TMPRSS2 là các enzym cần thiết cho sự phân cắt của protein S tại các vị trí S1/S2 và S2′, tương ứng [23]. Bestle và cộng sự đã chỉ ra rằng TMPRSS2 cần thiết cho việc mồi glycoprotein SARS-CoV-2 S thông qua việc hạ gục TMPRSS2 in-vitro trong tế bào biểu mô của người. Tương tự, họ tiết lộ rằng các chất ức chế furin tổng hợp đã ngăn chặn mạnh mẽ khả năng lây truyền của SARS-CoV-2 trong các tế bào biểu mô phổi và các tác dụng kháng vi rút mạnh hơn thu được khi kết hợp TMPRSS2 và các chất ức chế furin [23].
Dạng vật chủ SARS-CoV-2, các thụ thể ACE2, rất cần thiết cho việc điều hòa cân bằng nội môi của cơ thể người, bao gồm vận chuyển qua màng, renin-angiotensin (RAS) và hệ thống tim mạch [24], [25], [26]. ACE2 được biểu hiện rộng rãi trong tất cả các mô có biểu hiện tương đối cao hơn trong hệ hô hấp, bao gồm tế bào phế nang loại I và loại II, hệ thần kinh trung ương, hệ tim mạch, thận và đường tiêu hóa [27]. ACE2 hoạt động như một bộ điều chỉnh chính của RAS, chủ yếu bằng cách biến đổi Ang (angiotensin) I thành Ang 1–9 và Ang II thành Ang 1–7 [28]. Hoạt động của ACE2 xảy ra trong các bệnh phổi khác nhau, bao gồm tổn thương phổi và xơ hóa, tăng áp động mạch phổi và ARDS [29]. Gần đây, vai trò của ACE2 trong bệnh sinh COVID-19 đã được chú ý đáng kể do mối liên hệ quan trọng của nó với khả năng miễn dịch, viêm nhiễm, đường tiêu hóa và các bệnh tim mạch. Ái lực gắn kết của SARS-CoV-2 với ACE2 tương quan với tốc độ sao chép của virus, khả năng lây truyền và mức độ nghiêm trọng của bệnh [30]. Tương tác giữa ACE2 và protein S của virus được coi là một mục tiêu điều trị đầy hứa hẹn để sản xuất vắc xin [31].
Chúng tôi đã thực hiện tìm kiếm tài liệu toàn diện bằng cách sử dụng cơ sở dữ liệu PubMed / MEDLINE / để lấy thông tin các bài báo được xuất bản cho đến ngày 31/01/2021. Chúng tôi đã sử dụng các từ khóa sau: COVID-19, SARS-CoV-2, hút thuốc, ACE2, TMPRSS2, furin, và điều trị. Các ấn phẩm truy xuất được lựa chọn độc lập về mức độ liên quan và đóng góp của chúng; tìm kiếm tài liệu bị hạn chế bởi các đối tượng nghiên cứu (in-vitro, in-vivo, con người) và ngôn ngữ (tiếng Anh). Hơn nữa, các tài liệu tham khảo lấy từ các bài báo và từ các đánh giá gần đây về hút thuốc và COVID-19 đã được phân tích. Đánh giá này cũng bao gồm các ấn phẩm tập trung vào dịch tễ học và đặc điểm lâm sàng của COVID-19, mối liên quan của hút thuốc với COVID-19, ngoài các lựa chọn quản lý và điều trị đối với COVID-19.
3. HÚT THUỐC LÀ MỘT YẾU TỐ NGUY CƠ ĐỐI VỚI COVID-19
Hút thuốc lá là một yếu tố nguy cơ gây ra một số bệnh chuyển hóa tim mạch và hô hấp, bao gồm cả bệnh phổi tắc nghẽn mãn tính (COPD) và hen phế quản [32]. Hút thuốc lá thúc đẩy tiếp xúc với một số hóa chất độc hại, bao gồm 1,3-butadien, benzen và NO2 [33]. Nó có thể gây viêm đường hô hấp, dị ứng, tính thấm của tế bào biểu mô, hình thành chất nhầy và làm giảm sự thanh thải của niêm mạc [34].
Bằng chứng mạnh mẽ chỉ ra rằng nguy cơ nhiễm Mycobacterium tuberculosis gần như tăng gấp đôi do ức chế miễn dịch do hút thuốc gây ra. Tương tự, nguy cơ nhiễm cúm, mycoplasma pneumoniae, legionella và phế cầu khuẩn cao hơn 3-5 lần ở những người hút thuốc. [35]. Tuy nhiên, tài liệu về vai trò của việc hút thuốc trong cơ chế bệnh sinh của các đợt bùng phát coronavirus trước đây (coronavirus hội chứng hô hấp Trung Đông (MERS) và coronavirus hội chứng hô hấp nặng (SARS)) rất khan hiếm. Một nghiên cứu từ Hàn Quốc, chỉ dựa trên 26 mẫu, cho thấy hút thuốc làm tăng nguy cơ tử vong ở bệnh nhân MERS [36]. Mặc dù dữ liệu về các trường hợp COVID-19 còn ít, chúng tôi đã tổng hợp dữ liệu có sẵn so sánh tỷ lệ tử vong do bệnh ở người hút thuốc và người không hút thuốc (Bảng 3.1).
Bảng 3.1: Mối liên quan giữ hút thuốc lá và bệnh COVID-19
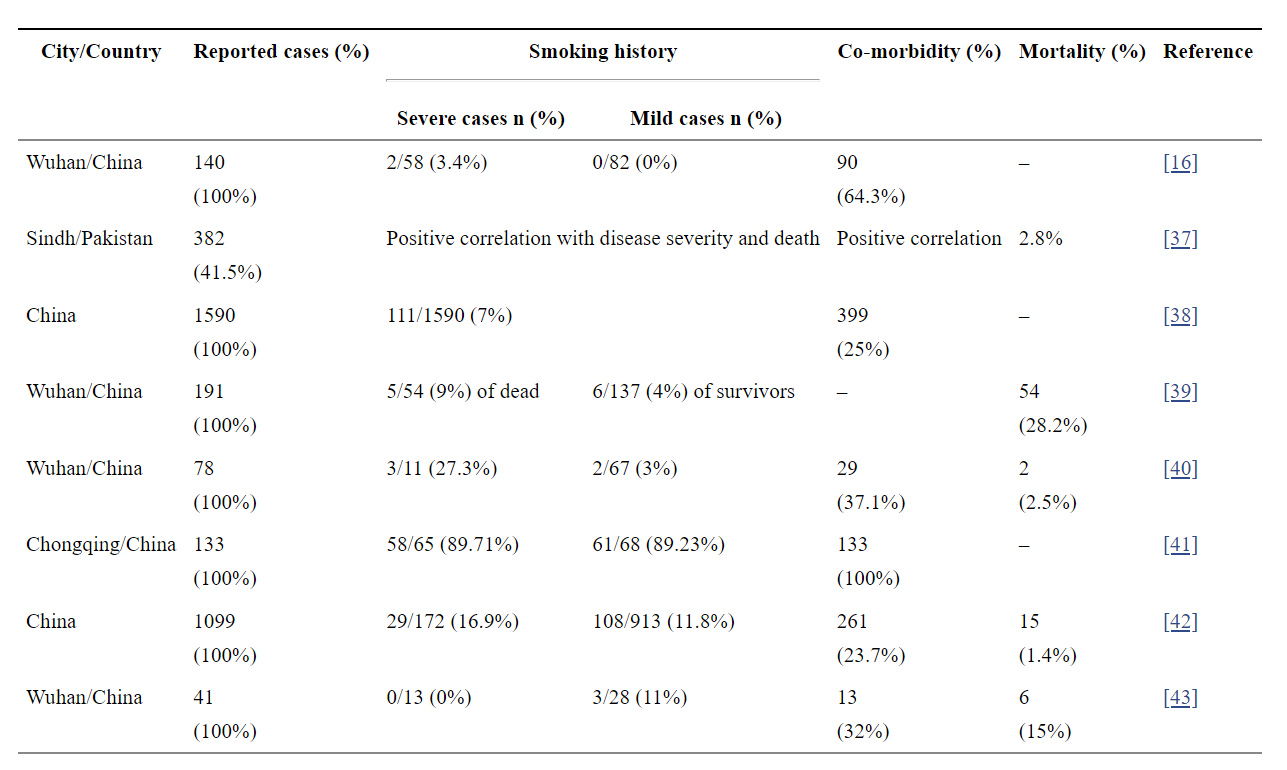
Một số nghiên cứu thuần tập COVID-19 đã phân tích tác động của hút thuốc đối với tỷ lệ mắc bệnh, bệnh đi kèm và tử vong, kết quả được tóm tắt trong Bảng 3.1. Các nghiên cứu báo cáo mối tương quan giữa hút thuốc và mức độ nghiêm trọng của COVID-19 hoặc chia nhóm thuần tập thành các trường hợp nhẹ và nặng, với tỷ lệ phần trăm số người hút thuốc trong mỗi nhóm. Theo Ujjan và cộng sự. [37], có mối tương quan giữa hút thuốc và mức độ nghiêm trọng của bệnh, với tất cả bệnh nhân đã qua đời (2,8%) đều là người hút thuốc. Tương tự, Zhou và cộng sự đã nghiên cứu 191 bệnh nhân nội trú, 54 người trong số họ chết khi ở bệnh viện và 137 người trong số họ đã xuất viện [39]. Họ phát hiện ra rằng những bệnh nhân đã chết có xu hướng hút thuốc nhiều hơn những người đang hồi phục. Mặc dù một số nghiên cứu tìm thấy mối liên hệ giữa mức độ nghiêm trọng của bệnh và hút thuốc [40], [42], nhưng một số ít không tìm thấy sự khác biệt hoặc mối tương quan nghịch giữa hút thuốc và mức độ nghiêm trọng COVID-19 [40], [41], [42], [43].
Zhao và cộng sự (2020) đã tiến hành phân tích tổng hợp 07 nghiên cứu phân tích mối liên quan giữa tử vong do COVID-19 với việc hút thuốc. Các tác giả nhận thấy rằng hút thuốc làm tăng gấp đôi nguy cơ mắc COVID ‐ 19 [44]. Tương tự, một phân tích tổng hợp của 13 nghiên cứu Trung Quốc đã công bố cho thấy rằng tuổi trên 65, giới tính nam và hút thuốc là các yếu tố nguy cơ tiến triển bệnh ở bệnh nhân COVID-19 [45]. Một phân tích tổng hợp khác được thực hiện bởi Patanavanich và Glantz (2020) cho thấy mối liên quan đáng kể giữa hút thuốc và sự tiến triển của COVID-19 [46]. Hơn nữa, một nghiên cứu khác cho thấy rằng hút thuốc hoặc từng hút thuốc là một yếu tố nguy cơ cao hơn đối với nhiễm COVID-19 nặng (OR = 1,96, CI = 1,36–2,83) và gây ra nhiều khả năng bị tình trạng nguy kịch hơn (OR = 1,79, CI = 1,19–2,70) [32].
Tuy nhiên, ngược lại, các nghiên cứu đã chứng minh sự thiếu liên quan giữa hút thuốc, COVID-19 và mức độ nghiêm trọng của bệnh COVID-19. Ngược lại, các nghiên cứu được thực hiện ở Trung Quốc báo cáo chỉ 25% bệnh nhân COVID-19 là người hút thuốc ở Ý, thấp nhất là 15% Bệnh nhân COVID-19 trước đây là người hút thuốc [15], [38], [47], [48], [49], [50].
4. TÁC ĐỘNG CỦA HÚT THUỐC ĐỐI VỚI SỰ BIỂU HIỆN CỦA CÁC GEN XÂM NHẬP CHÍNH CỦA SARC-CoV-2
Những người hút thuốc lá lâu năm hoặc tiếp xúc lâu với khói thuốc có xu hướng biểu hiện một số bệnh đồng mắc, bao gồm khí phế thũng, xơ vữa động mạch và rối loạn điều hòa miễn dịch, làm tăng thêm sự tiến triển của COVID-19 [51].
Tác giả Hùng và cộng sự nhận thấy rằng việc tiếp xúc với khói thuốc làm tăng hoạt động phổi của ACE2 và những con chuột loại trực tiếp ACE2 bị viêm phổi đáng kể và đau đớn khi phản ứng với khói thuốc lá [52]. Hút thuốc lá làm tăng nồng độ JNK, p38 và ERK1 / 2 ở phổi, cho thấy biểu hiện ACE2 do hút thuốc gây ra thúc đẩy viêm và tổn thương phổi [52]. Tương tự, biểu hiện bất thường do hút thuốc của con đường ACE2 có liên quan đến thay đổi khí máu, viêm phổi, phù nề và chấn thương [53]. Nitơ điôxít có trong khói thuốc lá giúp tăng cường liên kết của ACE2 với thụ thể của nó lên đến 100 lần bằng cách kích thích hoạt động của enzym ACE [33]. Radzikowska và cộng sự (2020) báo cáo rằng hút thuốc, hen suyễn, béo phì và tăng huyết áp có thể làm tăng biểu hiện ACE2 trong sinh thiết phế quản, rửa phế quản phế nang hoặc mẫu máu [54]. Tương tự, Brake và cộng sự (2020) báo cáo rằng hút thuốc điều chỉnh sự biểu hiện của thụ thể ACE2 ở bệnh nhân COVID-19 [55]. Hơn nữa, các nghiên cứu đã phát hiện ra biểu hiện tăng cao của ACE2 và TMPRSS2 ở một số nhóm bệnh nhân mắc bệnh phổi tắc nghẽn mãn tính (COPD) và xơ phổi vô căn (IPF) [51], [56], [57], [58], [59] , [60]; cả hai biểu hiện đều tương quan đáng kể với việc tiếp xúc với thuốc lá trước đó [56], [61], [62]; COPD được coi là một yếu tố nguy cơ chính của COVID-19 [63], [44].
Tuy nhiên, biểu hiện ACE2 không bị thay đổi ở bệnh nhân hen suyễn hoặc bệnh sarcoid phổi [51], [64], [65]. Ngược lại, Matusiak và Schürch đã thực hiện một nghiên cứu trên bệnh nhân hen và phát hiện thấy mất biểu hiện ACE2 trong biểu mô mũi và tăng biểu hiện TMPRSS2 trong phế quản và đường thở trung tâm [66]. Tương tự, Liu và cộng sự (2020) ghi nhận rằng nồng độ ACE2 trong huyết tương của bệnh nhân COVID-19 tăng lên đáng kể và tương quan tuyến tính với tải lượng virus và tổn thương phổi [67]. Một nghiên cứu khác của Leung và cộng sự. (2020) phân tích biểu hiện ACE2 trong biểu mô đường thở nhỏ của bệnh nhân COPD và chỉ ra rằng tần suất hút thuốc tương quan thuận với biểu hiện gen ACE2, tỷ lệ này cao hơn ở những người hút thuốc hiện tại so với những người không bao giờ hút thuốc [68]. Vì ACE2 được coi là một gen kích thích interferon, corticosteroid có thể được coi là một trong những lý do có thể làm mất biểu hiện ACE2 ở bệnh nhân hen suyễn [69]. Tuy nhiên, không có sự khác biệt đáng kể nào được tìm thấy trong biểu hiện furin ở cả bệnh nhân hen và người khỏe mạnh [66]. Hơn nữa, các nghiên cứu in-vivo cũng cho thấy biểu hiện ACE2 không thay đổi trong mô hình chuột bị xơ nang cũng như ở chuột tiếp xúc với một số chất gây ung thư (asen, bức xạ ion hóa (IR) và 1,3-butadiene) [51], [70] , [71], [72], [73].
Halwani và cộng sự [56] đã sử dụng bộ dữ liệu biểu hiện gen công khai để so sánh sự biểu hiện của ACE2 và TMPRSS2 trong mẫu máu của trẻ em và người lớn và không tìm thấy sự khác biệt đáng kể giữa chúng. Cũng không có sự khác biệt về biểu hiện của ACE2 và TMPRSS2 ở bệnh nhân COPD và đái tháo đường, trong khi có sự gia tăng biểu hiện của cả hai enzym ở bệnh nhân tăng huyết áp [56]. Tuy nhiên, ở bệnh nhân hen, chỉ có biểu hiện ACE2 tăng lên [56]. Ngoài ra, biểu hiện của ACE2 và TMPRSS2 trong đường thở của trẻ em thấp hơn so với người hút thuốc và bệnh nhân COPD, cho thấy lý do chính đáng cho sự khác biệt về mức độ nghiêm trọng của bệnh COVID-19 giữa các nhóm bệnh nhân khác nhau [56].
Một nghiên cứu gần đây của Cai và cộng sự [74] đã phân tích bộ dữ liệu phiên mã liên quan đến mối liên quan giữa hút thuốc và sự biểu hiện của các thụ thể SARS-CoV-2, ACE2, TMPRSS2 và furin trong các mô phổi. Họ phát hiện ra sự điều hòa biểu hiện ACE2 ở những người hút thuốc so với những người không hút thuốc với sự gia tăng 25% biểu hiện ở mô phổi [74]. Một nghiên cứu khác đã phân tích ACE2 ở cả chuột và các mô phổi của con người và nhận thấy sự biểu hiện của ACE2 tăng cường ở những người hút thuốc so với những người không hút thuốc [51]. Tiếp xúc với khói thuốc lá làm tăng biểu hiện ACE2 ở chuột lên 80%. Tương tự, tiếp xúc với khói trong các tế bào biểu mô phổi của người cho thấy tăng biểu hiện ACE2 lên 30–55% so với những người không hút thuốc [51]. Smith và cộng sự. [51] đã xác định ACE2 là một gen được kích thích bởi interferon trong tế bào tiết của biểu mô phổi. Họ chỉ ra rằng nhiễm trùng SARS-CoV-2 có thể tạo ra các vòng phản hồi tích cực, tăng thêm nồng độ ACE2 và cho phép lây lan vi-rút. Hơn nữa, Cai và cộng sự [74] đã kiểm tra tác động của hút thuốc đối với biểu hiện phổi của ACE2 trong các tế bào biểu mô phế quản đơn lẻ. Họ phát hiện ra rằng những thay đổi hình thái do hút thuốc gây ra trong các tế bào biểu mô phế quản. ACE2 cũng được phát hiện trong tế bào cốc tiết trong đường thở của người hút thuốc lá [51], [74], trong khi ở người không hút thuốc ACE2 chỉ được biểu hiện trong tế bào phế nang loại II [74], [75], cho thấy biểu hiện ACE2 tăng cao ở người hút thuốc. 'phổi như một dẫn xuất hợp lý của tăng sản tế bào bài tiết do hút thuốc lá. Hơn nữa, dữ liệu giải trình tự tế bào đơn cho thấy mức ACE2 có liên quan đáng kể với nhiều gen mucin (MUC1, MUC4, MUC15 và MUC16) và các gen liên quan đến hàng rào biểu mô khác (ALCAM, [76] CLDN7, [77] và TJP3 [78]) [51]. Ngoài ra, phân tích bản thể học gen cho thấy rằng các bản sao liên quan đến ACE2 tương quan với các gen điều chỉnh sự bài tiết, glycosyl hóa và phản ứng với các chất độc hại [79].
Bên cạnh đó, interferon gây ra biểu hiện ACE2 đáng kể. Mặc dù IFN-α, IFN-β và IFN-γ gây ra biểu hiện ACE2 trong tế bào khí quản, chỉ IFN-α và IFN-β làm thay đổi biểu hiện ACE2 trong các tế bào đường thở nhỏ [51], [80], [81], cho thấy rằng biểu hiện ACE2 có thể được gây ra một cách chính đáng do nhiễm virus hoặc điều trị bằng interferon [51]. So với những người không hút thuốc, yếu tố thúc đẩy chính của thụ thể ACE2 ở những người hút thuốc là ADAM17, gen thụ thể androgen (AR) [82], [83].
Một nghiên cứu khác đã xem xét mối quan hệ giữa biểu hiện ACE2 và các phương pháp hút thuốc khác nhau và báo cáo rằng hút thuốc lá nhưng không hút thuốc lá làm tăng biểu hiện ACE2 [84]. Hơn nữa, nghiên cứu phát hiện ra rằng hút nicotine và thuốc lá điện tử có hương vị dẫn đến tăng sản xuất cytokine tiền viêm và bệnh viêm [84]. Tương tự, nicotine điều chỉnh sự biểu hiện ACE2 [85] bằng cách kích hoạt thụ thể α7 nicotinic acetylcholine (nAChR) trên tế bào biểu mô phế quản [86], [87], cho thấy rằng những người hút thuốc có nguy cơ nhiễm SARS-CoV-2 cao hơn. Hơn nữa, nitric oxide (NO) cũng có trong khói thuốc lá và có thể làm suy giảm khả năng miễn dịch, làm tăng nguy cơ nhiễm SARS-CoV-2 [88]. Mặc dù các nghiên cứu đã chỉ ra NO là một yếu tố nguy cơ lây nhiễm SARS-CoV-2, vai trò của nicotine và NO trong COVID-19 vẫn còn nhiều tranh cãi. Ngược lại, các nghiên cứu khác nhau chỉ ra dữ liệu gây tranh cãi về vai trò điều chỉnh sự biểu hiện của ACE2 trong khói thuốc lá. Một nghiên cứu trong ống nghiệm đã phân tích ảnh hưởng của khói thuốc lá đối với sự biểu hiện của ACE2 bằng cách sử dụng các tế bào biểu mô phế quản ở người (H292) bằng một hệ thống giao diện không khí và chất lỏng [89]. Nghiên cứu chứng minh rằng tiếp xúc với khói thuốc lá gây ra mất biểu hiện mRNA ACE2 và không tìm thấy bất kỳ mối liên quan nào giữa biểu hiện ACE2 và giải phóng IL-6 từ các tế bào H292 tiếp xúc với khói thuốc; do đó, cho thấy rằng việc mất ACE2 trong tế bào phổi có thể do tác dụng trực tiếp của nicotin hoặc một số thành phần khác trong khói thuốc lá [89]. Hơn nữa, nghiên cứu này chỉ ra rằng nồng độ ACE2 mRNA tương quan cả ở người hút thuốc và người không hút thuốc và hút thuốc lá tác động có chọn lọc lên biểu mô phế quản bằng cách ức chế sự lây nhiễm virus và kích thích sự biểu hiện của các gen khác có thể kích hoạt một số con đường phiên mã [89]. Ngoài mức mRNA, nghiên cứu đã phân tích sự biểu hiện protein của ACE2 và báo cáo sự không nhất quán giữa mRNA và mức protein của ACE2; chỉ ra cấu hình biểu hiện protein có liên quan chính đáng đến thực tế là biểu hiện mRNA tăng cường có thể là hệ quả của cơ chế bù đắp cho sự mất biểu hiện protein ACE2 trên màng tế bào [89]. Nghiên cứu cũng cho thấy vai trò dược phẩm hợp lý của nicotine trong điều trị COVID-19 [89]. Một số nghiên cứu cho thấy nicotine có hoạt tính chống viêm bằng cách giảm viêm thông qua tiểu đơn vị nAChR α7 trên đại thực bào [17], [49], do đó, có thể tăng thêm giá trị điều trị. Tương tự, NO đã được chứng minh là có tác dụng làm giãn mạch phổi [90] và giảm nguy cơ mắc bệnh COVID-19 trầm trọng ở người hút thuốc [91].
Một nghiên cứu trước đây đã chứng minh hoạt động của ACE2 trong thận và mô mỡ của chuột đực cao hơn so với chuột cái; tuy nhiên, nghiên cứu không báo cáo biểu hiện ACE2 cao [92]. Tương tự, một nghiên cứu khác cũng báo cáo hoạt động ACE2 ở thận cao hơn ở nam giới so với nữ giới; Hoạt động của ACE2 thấp hơn ở thận phụ nữ là do sự hiện diện của E2 trong hormone buồng trứng [93]. Tuy nhiên, nghiên cứu báo cáo không có sự khác biệt về giới tính trong hoạt động của ACE2 ở tim và phổi [93], [94]. Hơn nữa, nghiên cứu đã chứng minh rằng hormone sinh dục (androgen và estrogen) điều chỉnh hệ thống renin-angiotensin [95], [96], [97], [98]; trong khi các nội tiết tố androgen làm tăng hoạt tính renin huyết tương [95], các estrogen làm giảm hoạt tính renin huyết tương [96]. Dựa trên điều này, Majdic (2020) đã đề xuất rằng hormone sinh dục có thể điều chỉnh sự biểu hiện của ACE2 trong phổi. Do đó, đây có thể là một trong những yếu tố cơ bản dẫn đến chênh lệch giới tính về tỷ lệ mắc và tử vong do COVID-19 [99]. Như đã được công bố, tỷ lệ tử vong do COVID-19 được phát hiện là phụ thuộc vào giới tính; ở Trung Quốc [100] và Ý [101], tỷ lệ tử vong của nam giới cao hơn đáng kể so với nữ giới. Biểu hiện ACE2 thấp hơn đáng kể ở các tế bào cơ trơn đường thở nguyên phát ở người nữ so với nam giới sử dụng phương pháp phân tích Western blot [102]. Hơn nữa, nghiên cứu đã chứng minh rằng việc tiếp xúc với testosterone và estrogen đã điều chỉnh đáng kể và điều hòa biểu hiện ACE2 tương ứng [102].
Hơn nữa, sự điều hòa hormone giới tính được phát hiện để điều chỉnh ACE2 và TMPRSS2, dẫn đến sự nhạy cảm khác nhau giữa giới tính với COVID-19. Trong khi biểu hiện ACE2 tăng lên ở phụ nữ do lệch nhiễm sắc thể X bất hoạt hoặc do estrogen, nồng độ androgen giảm ở phụ nữ dẫn đến biểu hiện TMPRSS2 thấp làm tăng vai trò bảo vệ của nó chống lại sự phát triển và tiến triển của COVID-19 [103]. Điều này chỉ ra rằng vai trò của hormone sinh dục và nhiễm sắc thể ảnh hưởng đến sự khác biệt về mức độ nghiêm trọng của nhiễm COVID-19 giữa các giới, do đó biểu hiện sự gia tăng nhạy cảm với COVID-19 ở nam giới [103]. Gần đây, Chakladar và cộng sự [83] đã tìm thấy sự đồng điều chỉnh của cả hai thụ thể SARS-CoV-2, ACE2 và TMPRSS2, ở những người hút thuốc so với những người không hút thuốc. Nghiên cứu sử dụng phân tích làm giàu bộ gen (GSEA) và tìm ra con đường tín hiệu androgen thích hợp với biểu hiện ACE2 và TMPRSS2 [83]. Voinsky và Gurwitz [104] báo cáo biểu hiện TMPRSS2 tăng cao trong các mẫu phế quản của những người hút thuốc so với những người không hút thuốc. Các nghiên cứu đã chỉ ra rằng hút thuốc làm tăng nồng độ nội tiết tố androgen [105], làm tăng biểu hiện của các thụ thể ACE2 và TMPRSS2 [83], [106]. Cùng với sự kích thích của con đường tín hiệu androgen, sự điều hòa của các thụ thể cũng tương quan với sự biểu hiện quá mức của cơ quan điều hòa trung ương (HDAC6, CTNNB1, và SMARCA4) của con đường androgen [83]. Tăng biểu hiện TPMRSS4 trong tế bào biểu mô phổi của người hút thuốc có thể do tiếp xúc lâu dài với một số hợp chất trong khói thuốc, bao gồm nicotin [107], acetaldehyde [108] và hắc ín [109], dẫn đến stress oxy hóa và viêm phế quản [110], [111], [112]. Ngược lại, Cai et al. [74] không tìm thấy bất kỳ mối tương quan nào giữa hút thuốc và biểu hiện TMPRSS2. Tương tự, một nghiên cứu khác cho thấy tiếp xúc với khói thuốc làm tăng biểu hiện của Cathepsin B, nhưng không làm tăng biểu hiện TMPRSS2 hoặc Cathepsin L trong đường hô hấp của chuột và người [51]. Hơn nữa, tương tự như biểu mô phổi, ở những người hút thuốc, biểu hiện ACE2 và TMPRSS2 được tăng cường trong biểu mô miệng; do đó, cho thấy tính nhạy cảm cao với SARS-CoV-2 trong tế bào biểu mô miệng [83].
Dựa trên các nghiên cứu được báo cáo, việc hút thuốc lá làm tăng hay giảm nguy cơ nhiễm COVID-19 còn gây tranh cãi. Một nghiên cứu ở Atlanta đã thực hiện phân tích trên sáu bệnh viện chăm sóc cấp tính và các phòng khám ngoại trú liên quan ở 220 bệnh nhân nhập viện và 311 bệnh nhân không nhập viện COVID-19 và báo cáo rằng hút thuốc là một yếu tố nguy cơ độc lập đối với việc nhập viện COVID-19 [113]. Hơn nữa, phân tích tổng hợp báo cáo những người hút thuốc có nguy cơ mắc bệnh nặng hoặc tiến triển cao hơn [114]. Không giống như hút thuốc, không có dữ liệu nào chứng minh tỷ lệ sử dụng vaping ở bệnh nhân COVID-19; tuy nhiên, người ta đã đưa ra giả thuyết rằng vaping có thể khiến phổi bị nhiễm SARS-CoV-2 và tương quan với các kết quả xấu nhất, chủ yếu dựa trên dữ liệu phụ trợ về các quá trình viêm phổi được mô tả trong các nghiên cứu in-vitro và in-vivo [115], [116 ]. Tuy nhiên, các nghiên cứu dịch tễ học đã không báo cáo về thói quen vaping so với báo cáo về việc hút thuốc ở những bệnh nhân COVID-19 nhập viện [117]. Trong khi, một nghiên cứu từ Đại học Stanford, dựa trên một cuộc khảo sát tự báo cáo trên internet, tiết lộ rằng việc sử dụng thuốc lá điện tử làm tăng nguy cơ nhiễm COVID-19 dương tính lên gấp 5 lần so với người không bao giờ sử dụng [118], ngược lại , các cuộc khảo sát tự báo cáo cắt ngang cho thấy thiếu mối liên quan giữa COVID-19 được chẩn đoán / nghi ngờ giữa những người chưa bao giờ, hiện tại và trước đó [119], [120]. Ngoài ra, Farsalinos và cộng sự báo cáo rằng tình trạng hút thuốc hiện tại tương đối thấp hơn ở bệnh nhân COVID-19; do đó, cho thấy vai trò bảo vệ của hút thuốc đối với COVID-19 [17]. Mặc dù hút thuốc lá có thể không làm tăng nguy cơ phát triển COVID-19 một cách chính đáng, nhưng dòng tín hiệu sinh học và viêm xảy ra trong quá trình nhiễm SARS-CoV-2 có thể có khả năng tàn phá đối với người hút thuốc.
5. DỰ KẾN CÁC MỤC TIÊU ĐIỀU TRỊ
Các loại thuốc bao gồm chloroquine và hydroxychloroquine hiện được chấp thuận cho bệnh sốt rét và các bệnh tự miễn dịch. Một số quốc gia đã sử dụng rộng rãi chúng để điều trị COVID-19 [121], [122]. Tuy nhiên, do các tác dụng phụ bất lợi của chúng, bao gồm mất thị lực, buồn nôn và các biến chứng tim mạch, cả chloroquine và hydroxychloroquine đều không được khuyến cáo trong môi trường lâm sàng để điều trị COVID-19. Nó được chứng minh rằng chloroquine và hydroxychloroquine phát huy tác dụng của chúng bằng cách tích tụ trong tế bào lympho và đại thực bào, do đó ức chế tiết cytokine gây viêm và kích hoạt tế bào T chống SARS-CoV-2 CD8 + [123]. Một số thuốc điều hòa miễn dịch và thuốc chống viêm khác cũng đang được thử nghiệm trong các thử nghiệm lâm sàng [124].
Mặt khác, các biện pháp can thiệp điều trị mới là cần thiết khẩn cấp để ngăn chặn hoặc làm chậm quá trình sao chép và lây lan của vi rút. Nhiều lựa chọn điều trị hiện đang được nghiên cứu ngoài việc phát triển vắc-xin, bao gồm các loại thuốc có đặc tính kháng vi-rút và miễn dịch riêng biệt [39], [125]. Các nỗ lực nhằm che giấu các thụ thể chức năng COVID-19 trên tế bào người, ACE2 và TMPRSS2 [39], [125]. Một số chiến lược điều trị đối với COVID-19 đã được khuyến nghị, bao gồm các loại thuốc có sẵn (chloroquine, hydroxychloroquine, remdesivir và lopinavir) để điều trị virus, mô hình hóa protein và phân tích di truyền bằng một số kỹ thuật tính toán [126], [127], [128] , [129], [130]. Camostat, chất ức chế serine protease, ngăn chặn cả TMPRSS2 và TMPRSS4 và làm giảm sự nhân lên của virus cúm và sản xuất cytokine trong các tế bào biểu mô khí quản ở người [131]. Do đó, camostat được đề xuất như một chất điều trị COVID ‐ 19 tiềm năng [132].
Giảm hoặc bỏ hút thuốc có thể làm chậm sự phá hủy cấu trúc biểu mô đường hô hấp [133], giảm tăng sản tế bào bài tiết [134], và giảm bài tiết ACE2 đến 40% [51]. ACE2 hòa tan được coi là một lựa chọn điều trị hợp lý trong trường hợp ACE2 được biểu hiện quá mức trong biểu mô đường thở ở những người hút thuốc lá [135]. Monteil và cộng sự. [136] cho thấy rằng ACE-2 hòa tan tái tổ hợp ở người (hrsACE2) làm giảm tải lượng virus SARS-CoV-2 trong các tế bào Vero-E6 bị nhiễm bệnh, thận và các organoids mạch máu. Ở Châu Âu, hrsACE2 đang được thử nghiệm lâm sàng Giai đoạn 2 (ClinicalTrials.gov NCTO4335136) như một tác nhân điều trị cho COVID-19 [137]. Tuy nhiên, hiệu quả của liệu pháp này ở người hút thuốc và bệnh nhân COPD có nồng độ ACE2 tăng cao cần phải được xác định. Hơn nữa, việc sử dụng phương pháp điều trị và thực phẩm chức năng để bình thường hóa nồng độ NO ở người hút thuốc nên được xem xét để giảm thiểu tỷ lệ mắc bệnh COVID-19 và các biến chứng của nó [88].
Các cuộc điều tra sử dụng mô hình in-vitro và thuốc chống vi-rút (lopinavir và ritonavir) có hiệu quả chống lại nhiễm vi-rút suy giảm miễn dịch ở người (HIV-1), vi-rút SARS-CoV, MERS-CoV và SARS-CoV-2 [138], [ 139]. Tuy nhiên, nghiên cứu đã chỉ ra rằng cả lopinavir và ritonavir đều không cải thiện triệu chứng so với chăm sóc tiêu chuẩn ở bệnh nhân COVID-19 nặng [140], [141]. Tuy nhiên, sự kết hợp của lopinavir-ritonavir với oseltamivir cho thấy sự hồi phục hoàn toàn sau viêm phổi COVID-19 [142], [143]. Mặt khác, remdesivir đã được chứng minh là có hiệu quả ức chế SARS-CoV-2 trong các nghiên cứu in-vitro bằng cách sử dụng tế bào Vero E6 [126], [144].
TÀI LIỆU THAM KHẢO
1. Zhou, P., et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin. 2020. 579(7798): p. 270-273.
2. Organization, W.H., Coronavirus disease (COVID-19): weekly epidemiological update. 2020.
3. Dong, E., H. Du, and L.J.T.L.i.d. Gardner, An interactive web-based dashboard to track COVID-19 in real time. 2020. 20(5): p. 533-534.
4. Van Doremalen, N., et al., Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. 2020. 382(16): p. 1564-1567.
5. Cascella, M., et al., Features, evaluation and treatment coronavirus (COVID-19), in Statpearls [internet]. 2020, StatPearls Publishing.
6. Wang, Y., et al., Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID‐19) implicate special control measures. 2020. 92(6): p. 568-576.
7. Ramadan N., Shaib H. Middle East respiratory syndrome coronavirus (MERS-CoV): A review. Germs. 2019;9(1):35–42.
8. Vijayanand P., Wilkins E., Woodhead M. Severe acute respiratory syndrome (SARS): a review. Clin Med. 2004;4:152–160.
9. Brake S.J. Smoking upregulates angiotensin-converting enzyme-2 receptor: a potential adhesion site for novel coronavirus SARS-CoV-2 (Covid-19) J Clin Med. 2020;9(3):841.
10. Hassan S.A. Coronavirus (COVID-19): a review of clinical features, diagnosis. and treatment. 2020;12(3).
11. Eapen, M.S., et al., Dysfunctional immunity and microbial adhesion molecules in smoking-induced pneumonia. 2019. 199(2): p. 250-251.
12. Han, L., et al., Smoking and influenza-associated morbidity and mortality: a systematic review and meta-analysis. 2019. 30(3): p. 405-417.
13. Lawrence, H., et al., Cigarette smoking and the occurrence of influenza–Systematic review. 2019. 79(5): p. 401-406.
14. Alqahtani, J.S., et al., Prevalence, severity and mortality associated with COPD and smoking in patients with COVID-19: a rapid systematic review and meta-analysis. 2020. 15(5): p. e0233147.
15. Guan W.-J. Clinical characteristics of coronavirus disease 2019 in. China. 2020;382(18):1708–1720.
16. Zhang J.-J. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. 2020;75(7):1730–1741.
17. Farsalinos K. COVID-19 and the nicotinic cholinergic system. Eur Respir J. 2020;56(1):2001589.
18. Leung J.M., Sin D.D. Smoking, ACE-2, and COVID-19: ongoing controversies. Eur Respir J. 2020:2001759.
19. Hoffmann M. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and Is blocked by a clinically proven protease inhibitor. Cell. 2020;181(2):271–280.e8.
20. Li, F., et al., Structure of SARS coronavirus spike receptor-binding domain complexed with receptor. 2005. 309(5742): p. 1864-1868.
21. Coutard, B., et al., The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. 2020. 176: p. 104742.
22. Heurich A. TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein. J Virol. 2014;88(2):1293–1307.
23. Bestle D. TMPRSS2 and furin are both essential for proteolytic activation of SARS-CoV-2 in human airway cells. Life Sci Alliance. 2020;3(9)
24. Gheblawi, M., et al., Angiotensin-converting enzyme 2: SARS-CoV-2 receptor and regulator of the renin-angiotensin system: celebrating the 20th anniversary of the discovery of ACE2. 2020. 126(10): p. 1456-1474.
25. Rey-Parra, G., et al., Angiotensin converting enzyme 2 abrogates bleomycin-induced lung injury. 2012. 90(6): p. 637-647.
26. Zheng, Y.-Y., et al., COVID-19 and the cardiovascular system. 2020. 17(5): p. 259-260.
27. Hikmet, F., et al., The protein expression profile of ACE2 in human tissues. Molecular systems biology, 2020. 16(7): p. e9610-e9610.
28. Wang, K., M. Gheblawi, and G.Y.J.C. Oudit, Angiotensin converting enzyme 2: a double-edged sword. 2020.
29. Kuba, K., Y. Imai, and J.M.J.C.o.i.p. Penninger, Angiotensin-converting enzyme 2 in lung diseases. 2006. 6(3): p. 271-276.
30. Liu, Y., et al., Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. 2020. 63(3): p. 364-374.
31. Lurie, N., et al., Developing Covid-19 vaccines at pandemic speed. 2020. 382(21): p. 1969-1973.
32. Jiménez-Ruiz C.A. COVID-19 and smoking: a systematic review and meta-analysis of the evidence. Arch Bronconeumol. 2021;57(Suppl 1):21–34
33. Hagenbjörk-Gustafsson A. Determinants of personal exposure to some carcinogenic substances and nitrogen dioxide among the general population in five Swedish cities. J Eposure Sci Environ Epidemiol. 2014;24(4):437–443.
34. Strzelak A. Tobacco smoke induces and alters immune responses in the lung triggering inflammation, allergy, asthma and other lung diseases: A Mechanistic review. Int J Environ Res Public Health. 2018;15(5)
35. van Zyl-Smit R.N., Richards G., Leone F.T. Tobacco smoking and COVID-19 infection. Lancet Respir Med. 2020;8(7):664–665.
36. Nam H.-S. High fatality rates and associated factors in two hospital outbreaks of MERS in Daejeon, the Republic of Korea. Int J Infect Dis. 2017;58:37–42.
37. Ujjan I.D. The clinical and demographical profile of Coronavirus illness: The tale of Tablighi Jamaat and Zaireen in Quarantine/Isolation center at Sukkur and Hyderabad. Pak J Med Sci. 2020;36(Covid19-s4):S12–S16.
38. Guan W.J. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J. 2020;55(5)
39. Zhou F. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054–1062.
40. Liu W. Analysis of factors associated with disease outcomes in hospitalized patients with 2019 novel coronavirus disease. Chin Med J (Engl) 2020;133(9):1032–1038.
41. Chen X. Retrospective study on the epidemiological characteristics of 139 patients with novel coronavirus pneumonia on the effects of severity. Chongqing Med. 2020:1–9.
42. Guan W.J. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720.
43. Huang C. Clinical features of patients infected with 2019 novel coronavirus in Wuhan. China Lancet. 2020;395(10223):497–506.
44. Zhao Q. The impact of COPD and smoking history on the severity of COVID-19: A systemic review and meta-analysis. J Med Virol. 2020;92(10):1915–1921.
45. Zheng Z. Risk factors of critical & mortal COVID-19 cases: A systematic literature review and meta-analysis. J Infect. 2020;81(2):e16–e25.
46. Patanavanich R., Glantz S.A. Smoking is associated with COVID-19 progression: A meta-analysis. Nicotine Tob Res. 2020;22(9):1653–1656.
47. Emami A. Prevalence of underlying diseases in hospitalized patients with COVID-19: a systematic review and meta-analysis. Arch Acad Emerg Med. 2020;8(1)
48. Lippi G., Henry B.M. Active smoking is not associated with severity of coronavirus disease 2019 (COVID-19) Eur J Intern Med. 2020;75:107–108.
49. Farsalinos K., Barbouni A., Niaura R. Systematic review of the prevalence of current smoking among hospitalized COVID-19 patients in China: could nicotine be a therapeutic option? Intern Emerg Med. 2020;15(5):845–852.
50. Rossato M. Current smoking is not associated with COVID-19. Eur Respir J. 2020;55(6):2001290.
51. Smith J.C. Cigarette smoke exposure and inflammatory signaling increase the expression of the SARS-CoV-2 receptor ACE2 in the respiratory tract. Dev Cell. 2020;53(5):514–529.e3.
52. Hung Y.H. Alternative roles of STAT3 and MAPK signaling pathways in the MMPs activation and progression of lung injury induced by cigarette smoke exposure in ACE2 knockout mice. Int J Biol Sci. 2016;12(4):454–465.
53. Yilin, Z., N. Yandong, and J.J.B. Faguang, Role of angiotensin-converting enzyme (ACE) and ACE2 in a rat model of smoke inhalation induced acute respiratory distress syndrome. 2015. 41(7): p. 1468-1477.
54. Radzikowska U. Distribution of ACE2, CD147, CD26, and other SARS-CoV-2 associated molecules in tissues and immune cells in health and in asthma, COPD, obesity, hypertension, and COVID-19 risk factors. Allergy. 2020;75(11):2829–2845.
55. Brake S.J. Smoking upregulates angiotensin-converting enzyme-2 receptor: A potential adhesion site for novel coronavirus SARS-CoV-2 (Covid-19) J Clin Med. 2020;9(3)
56. Saheb Sharif-Askari N. Airways expression of SARS-CoV-2 receptor, ACE2, and TMPRSS2 Is lower in children than adults and increases with smoking and COPD. Mol Ther Methods Clin Dev. 2020;18:1–6.
57. Cruz T. Multi-level immune response network in mild-moderate Chronic Obstructive Pulmonary Disease (COPD) Respir Res. 2019;20(1):152.
58. Kim W.J. Comprehensive analysis of transcriptome sequencing data in the lung tissues of COPD subjects. Int J Genom. 2015;2015
59. McDonough J.E. Transcriptional regulatory model of fibrosis progression in the human lung. JCI Insight. 2019;4(22)
60. Pardo A. Up-regulation and profibrotic role of osteopontin in human idiopathic pulmonary fibrosis. PLoS Med. 2005;2(9)
61. Baumgartner K.B. Cigarette smoking: a risk factor for idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 1997;155(1):242–248.
62. Laniado-Laborín, R., Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21 century. International journal of environmental research and public health, 2009. 6(1): p. 209-224.
63. Lippi G., Henry B.M. Chronic obstructive pulmonary disease is associated with severe coronavirus disease 2019 (COVID-19) Respir Med. 2020;167
64. Crouser E.D. Gene expression profiling identifies MMP-12 and ADAMDEC1 as potential pathogenic mediators of pulmonary sarcoidosis. Am J Respir Crit Care Med. 2009;179(10):929–938.
65. Voraphani N. An airway epithelial iNOS-DUOX2-thyroid peroxidase metabolome drives Th1/Th2 nitrative stress in human severe asthma. Mucosal Immunol. 2014;7(5):1175–1185.
66. Matusiak M., Schürch C.M. Expression of SARS-CoV-2 entry receptors in the respiratory tract of healthy individuals, smokers and asthmatics. Respir Res. 2020;21(1):252.
67. Liu Y. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci China Life Sci. 2020;63(3):364–374.
68. Leung J.M. ACE-2 expression in the small airway epithelia of smokers and COPD patients: implications for COVID-19. Eur Respir J. 2020;55(5)
69. Ziegler C.G.K. SARS-CoV-2 Receptor ACE2 Is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell. 2020;181(5):1016–1035.e19.
70. Chappell G.A. Variation in DNA-damage responses to an inhalational carcinogen (1,3-butadiene) in relation to strain-specific differences in chromatin accessibility and gene transcription profiles in C57BL/6J and CAST/EiJ mice. Environ Health Perspect. 2017;125(10)
71. Citrin D.E. Role of type II pneumocyte senescence in radiation-induced lung fibrosis. J Natl Cancer Inst. 2013;105(19):1474–1484.
72. Haston C.K. Strain-dependent pulmonary gene expression profiles of a cystic fibrosis mouse model. Physiol Genomics. 2006;25(2):336–345.
73. Kozul C.D. Chronic exposure to arsenic in the drinking water alters the expression of immune response genes in mouse lung. Environ Health Perspect. 2009;117(7):1108–1115.
74. Cai G. Tobacco smoking increases the lung gene expression of ACE2, the receptor of SARS-CoV-2. Am J Respir Crit Care Med. 2020;201(12):1557–1559.
75. Lukassen S. SARS-CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells. The EMBO Journal. 2020;
76. Tomita K. Coordinate recruitment of E-cadherin and ALCAM to Cell-Cell contacts by α-catenin. Biochem Biophys Res Commun. 2000;267(3):870–874.
77. Farkas A.E. HNF4α regulates claudin-7 protein expression during intestinal epithelial differentiation. Am J Pathol. 2015;185(8):2206–2218.
78. González-Mariscal L. Tight junction proteins. Prog Biophys Mol Biol. 2003;81(1):1–44.
79. Fahy J.V., Dickey B.F. Airway Mucus Function and Dysfunction. N Engl J Med. 2010;363(23):2233–2247.
80. Rusinova I. INTERFEROME v2.0: an updated database of annotated interferon-regulated genes. Nucleic Acids Res. 2012;41(D1):D1040–D1046.
81. Shapira S.D. A Physical and Regulatory map of host-influenza interactions reveals pathways in H1N1 Infection. Cell. 2009;139(7):1255–1267.
82. Pedersen K.B. Dynamics of ADAM17-mediated shedding of ACE2 applied to pancreatic islets of male db/db mice. Endocrinology. 2015;156(12):4411–4425.
83. Chakladar J. Smoking-mediated upregulation of the androgen pathway leads to increased SARS-CoV-2 susceptibility. Int J Mol Sci. 2020;21(10):3627.
84. Lee A.C. Tobacco, but not nicotine and flavor-less electronic cigarettes, induces ACE2 and immune dysregulation. Int J Mol Sci. 2020;21(15):5513.
85. Olds J.L., Kabbani N. Is nicotine exposure linked to cardiopulmonary vulnerability to COVID-19 in the general population? FEBS J. 2020;287(17):3651–3655.
86. Leung J.M., Yang C.X., Sin D.D. COVID-19 and nicotine as a mediator of ACE-2. Eur Respir J. 2020;55(6):2001261.
87. Russo P. COVID-19 and smoking: is nicotine the hidden link? Eur Respir J. 2020;55(6)
88. Stefano G.B., Esch T., Kream R.M. Potential Immunoregulatory and Antiviral/SARS-CoV-2 Activities of Nitric Oxide. Med Sci Monit. 2020;26
89. Caruso M. Role of cigarette smoke on ACE-2 protein membrane expression in bronchial epithelial cells using an air-liquid interface model. Front Pharmacol. 2020 In Press.
90. Stewart D.L. Effect of inhaled nitric oxide on oxygen therapy, mechanical ventilation, and hypoxic respiratory failure. Minerva Pediatr. 2018;70(1):51–58.
91. Hedenstierna G. Nitric oxide dosed in short bursts at high concentrations may protect against Covid 19. Nitric Oxide. 2020;103:1–3.
92. Gupte M. Angiotensin converting enzyme 2 contributes to sex differences in the development of obesity hypertension in C57BL/6 mice. Arterioscler Thromb Vasc Biol. 2012;32(6):1392–1399.
93. Liu, J., et al., Sex differences in renal angiotensin converting enzyme 2 (ACE2) activity are 17β-oestradiol-dependent and sex chromosome-independent. Biology of sex differences, 2010. 1(1): p. 6-6.
94. Cai, G., Bulk and single-cell transcriptomics identify tobacco-use disparity in lung gene expression of ACE2, the receptor of 2019-nCov. medRxiv, 2020.
95. Reckelhoff J.F. Gender differences in the regulation of blood pressure. Hypertension. 2001;37(5):1199–1208.
96. McGuire B.B. Gender differences in the renin-angiotensin and nitric oxide systems: relevance in the normal and diseased kidney. Kidney Blood Press Res. 2007;30(2):67–80.
97. Rabi D.M. Reporting on sex-based analysis in clinical trials of angiotensin-converting enzyme inhibitor and angiotensin receptor blocker efficacy. Can J Cardiol. 2008;24(6):491–496.
98. White M.C., Fleeman R., Arnold A.C. Sex differences in the metabolic effects of the renin-angiotensin system. Biol Sex Differ. 2019;10(1):31.
99. Majdic G. Could Sex/gender differences in ACE2 expression in the lungs contribute to the large gender disparity in the morbidity and mortality of patients infected with the SARS-CoV-2 Virus? Front Cell Infect Microbiol. 2020;10:327. [
100. The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) — China, 2020. China CDC Weekly. 2020;2(8):113–122.
101. Fabiani M. Epidemiological characteristics of COVID-19 cases in non-Italian nationals notified to the Italian surveillance system. Eur J Public Health. 2021;31(1):37–44.
102. Kalidhindi R.S.R. Sex steroids skew ACE2 expression in human airway: a contributing factor to sex differences in COVID-19? Am J Physiolo-Lung Cell Mol Physiol. 2020;319(5):L843–L847.
103. Foresta C., Rocca M.S., Di Nisio A. Gender susceptibility to COVID-19: a review of the putative role of sex hormones and X chromosome. J Endocrinol Invest. 2020:1–6.
104. Voinsky I., Gurwitz D. Smoking and COVID-19: Similar bronchial ACE2 and TMPRSS2 expression and higher TMPRSS4 expression in current versus never smokers. Drug Dev Res. 2020;81(8):1073–1080.
105. Wang W. Cigarette smoking has a positive and independent effect on testosterone levels. Hormones (Athens) 2013;12(4):567–577.
106. Qing E. Evaluating MERS-CoV Entry Pathways. Methods Mol Biol. 2020;2099:9–20.
107. Benowitz N.L. Drug therapy. Pharmacologic aspects of cigarette smoking and nicotine addiction. N Engl J Med. 1988;319(20):1318–1330.
108. Seeman J.I., Dixon M., Haussmann H.J. Acetaldehyde in mainstream tobacco smoke: formation and occurrence in smoke and bioavailability in the smoker. Chem Res Toxicol. 2002;15(11):1331–1350.
109. Burns D.M. Cigarettes and cigarette smoking. Clin Chest Med. 1991;12(4):631–642.
110. Lim T.K. Effects of nonsteroidal anti-inflammatory drugs on the bronchial hyperresponsiveness of middle-aged male smokers. Eur Respir J. 1990;3(8):872–879.
111. Siew L.Q.C. Cigarette smoking increases bronchial mucosal IL-17A expression in asthmatics, which acts in concert with environmental aeroallergens to engender neutrophilic inflammation. Clin Exp Allergy. 2017;47(6):740–750.
112. Son E.S. Effects of antioxidants on oxidative stress and inflammatory responses of human bronchial epithelial cells exposed to particulate matter and cigarette smoke extract. Toxicol In Vitro. 2020;67
113. Marie E, K., et al., Characteristics Associated with Hospitalization Among Patients with COVID-19 — Metropolitan Atlanta, Georgia, March–April 2020. MMWR Morb Mortal Wkly Rep, 2020. 69(25): p. 790-794.
114. Karanasos A. Impact of smoking status on disease severity and mortality of hospitalized patients with COVID-19 infection: a systematic review and meta-analysis. Nicotine Tob Res. 2020;22(9):1657–1659.
115. McAlinden K.D. COVID-19 and vaping: risk for increased susceptibility to SARS-CoV-2 infection? Eur Respir J. 2020;56(1):2001645.
116. Reidel B. E-cigarette use causes a unique innate immune response in the lung, involving increased neutrophilic activation and altered mucin secretion. Am J Respir Crit Care Med. 2018;197(4):492–501.
117. Sussman R.A., Golberstein E., Polosa R. Aerial transmission of the SARS-CoV-2 virus through environmental E-cigarette aerosols: implications for public policies. Int J Environ Res Public Health. 2021;18(4):1437.
118. Gaiha S.M., Cheng J., Halpern-Felsher B. Association between youth smoking, electronic cigarette use, and COVID-19. J Adolesc Health. 2020;67(4):519–523.
119. Kale D. Associations between vaping and Covid-19: Cross-sectional findings from the HEBECO study. Drug Alcohol Depend. 2021;221
120. Caponnetto, P., et al., Smoking behavior and psychological dynamics during COVID-19 social distancing and stay-at-home policies: A survey. Health psychology research, 2020. 8(1): p. 9124-9124.
121. Rolain J.M., Colson P., Raoult D. Recycling of chloroquine and its hydroxyl analogue to face bacterial, fungal and viral infections in the 21st century. Int J Antimicrob Agents. 2007;30(4):297–308.
122. Dong L., Hu S., Gao J. Discovering drugs to treat coronavirus disease 2019 (COVID-19) Drug Discov Ther. 2020;14(1):58–60.
123. Savarino A. New insights into the antiviral effects of chloroquine. Lancet Infect Dis. 2006;6(2):67–69.
124. Fragkou P.C. Review of trials currently testing treatment and prevention of COVID-19. Clin Microbiol Infect. 2020;26(8):988–998.
125. Sanders, J.M., et al., Pharmacologic treatments for coronavirus disease 2019 (COVID-19): a review. 2020. 323(18): p. 1824-1836.
126. Wang M. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020;30(3):269–271.
127. Zhou Y. Network-based drug repurposing for novel coronavirus 2019-nCoV/SARS-CoV-2. Cell Discov. 2020;6(1):14.
128. Lin S.M. Structure-based stabilization of non-native protein-protein interactions of coronavirus nucleocapsid proteins in antiviral drug design. J Med Chem. 2020;63(6):3131–3141. [PMC free article] [PubMed] [Google Scholar]
129. Gordon D.E. A SARS-CoV-2 protein interaction map reveals targets for drug repurposing. Nature. 2020;583(7816):459–468.
130. Kandeel M., Al-Nazawi M. Virtual screening and repurposing of FDA approved drugs against COVID-19 main protease. Life Sci. 2020;
131. Yamaya M. The serine protease inhibitor camostat inhibits influenza virus replication and cytokine production in primary cultures of human tracheal epithelial cells. Pulm Pharmacol Ther. 2015;33:66–74.
132. Uno Y. Camostat mesilate therapy for COVID-19. Intern Emerg Med. 2020:1–2.
133. Bertram J.F., Rogers A.W. Recovery of bronchial epithelium on stopping smoking. Brit Med J (Clin Res ed) 1981;283(6306):1567–1569.
134. Lee J.J. Long-term impact of smoking on lung epithelial proliferation in current and former smokers. J Natl Cancer Inst. 2001;93(14):1081–1088.
135. Lutchman D. Could the smoking gun in the fight against Covid-19 be the (rh) ACE2? Eur Respir J. 2020:2001560.
136. Monteil V. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 2020;181(4):905–913.e7.
137. Bundgaard, H. Recombinant Human Angiotensin-converting Enzyme 2 (rhACE2) as a Treatment for Patients With COVID-19 (APN01-COVID-19).
138. Chen F. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds. J Clin Virol. 2004;31(1):69–75.
139. Sheahan T.P. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun. 2020;11(1):222.
140. Chen J.L., Xi X., Liu P., Li F., Li T. Efficacies of lopinavir/ritonavir and abidol in the treatment of novel coronavirus pneumonia. Chin J Infect. 2020;38:E008.
141. Verdugo-Paiva F. Lopinavir-ritonavir for COVID-19: A living systematic review. Medwave. 2020;20(6)
142. Wu A. Genome composition and divergence of the novel coronavirus (2019-nCoV) originating in China. Cell Host Microbe. 2020;27(3):325–328.
143. Wu C. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharm Sin B. 2020;10(5):766–788. [
144. Wang, D., et al., Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China. 2020. 323(11): p. 1061-1069.